一文读懂医疗器械注册认证
导读随着我国相关行业的技术革新及产业链的日渐成熟,医疗器械产业正在进入高速发展期,市场容量不断扩大,医疗器械产品认证需求与日俱增。

然而,鉴于当前国际市场认证种类的多样性和法律法规的持续变动,很多医疗器械厂商对相关产品注册/认证的内容和流程都不甚了解,如何顺利通过医疗器械注册/认证仍是许多企业亟需解决的问题。
本文特别邀请了广电计量医疗器械认证领域的资深专家,带您全方位的了解医疗器械注册/认证类型、流程及注意事项等,帮助您少走弯路,快速获得市场准入资质。
一、什么是医疗器械注册//认证?
医疗器械注册/认证是食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
医疗器械备案是医疗器械备案人向食品药品监督管理部门提交备案资料,食品药品监督管理部门对提交的备案资料存档备查。
医疗器械产品注册认证是医疗器械产品上市销售的合格证明。
二、哪些产品需要进行医疗器械注册/认证?
被定义为医疗器械的产品需要进行注册/认证,这些产品通常是指制造商的预期用途是为下列一个或多个特定医疗目的用于人类的,不论单独使用或组合使用的仪器、设备、器具、机器、用具、植入物、体外试剂、软件或其他相似或相关物品。这些目的包括:
■疾病的诊断、预防、监护、治疗或者缓解;
■损伤的诊断、监护、治疗、缓解或者补偿;
■解剖或生理过程的研究、替代、调节或者支持;
■支持或维持生命;
■妊娠控制;
■医疗器械的消毒;
■通过对取自人体的样本进行体外检查的方式来提供医疗信息; 其作用于人体体表或体内的主要设计作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
值得注意的是,有些产品在某些管辖范围内可认为是医疗器械,而在其他地方不认为是医疗器械的产品包括:
■消毒物质;
■残疾人的辅助用品;
■含有动物和(或)人体组织的器械;
■用于体外受精或生育辅助的器械。
三、 对于医疗器械注册/认证,当前国际国内的主流法规有哪些?
当前国际国内的主流法规有三大类,分别是中国NMPA医疗器械注册、欧盟CE认证和美国FDA认证:
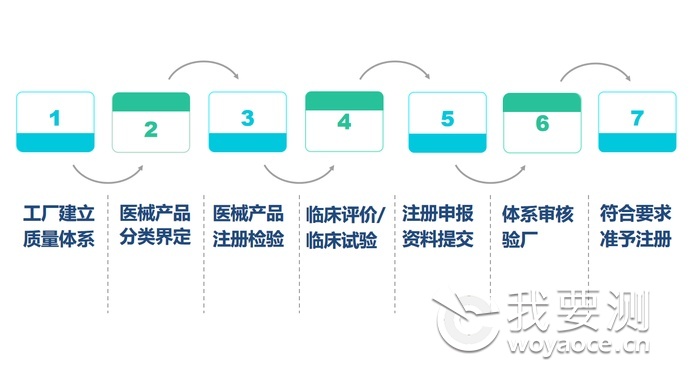
1、 中国NMPA医疗器械注册/备案
根据中国国务院《医疗器械监督管理条例》规定,任何生产企业希望在中国境内销售、使医疗器械( 包含境内和境外的器械),都应当向相应的食品药品监督管理部门进行注册,按照其风险等级主要分为三类:
■第一类医疗器械(风险程度低,如纱布、绷带等),实行产品备案管理;
■第二类医疗器械(中度风险,如输液器、手术手套等),实行产品注册管理;
■第三类医疗器械(较高风险,如支架、人工关节等),需要实行产品注册管理。
NMPA注册流程如下:
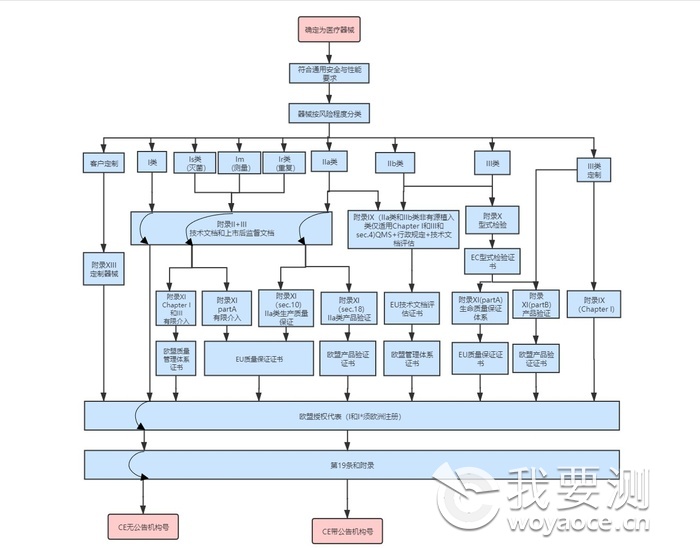
2、 欧盟CE认证
在欧盟市场,“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》法规的基本要求。欧盟CE认证是进入欧盟市场的通行证,出口到欧盟的医疗器械没有CE认证无法清关。根据医疗器械的风险不同,在欧盟市场医疗器械被划分为Ⅰ、Ⅱa、Ⅱb、Ⅲ四个类别:
■低风险性医疗器械属于I类,包括:
■普通I类医疗器械,需出具CE符合性报告;
■具有无菌及测量功能的特殊I类医疗器械,需要CE证书,并在产品包装上打上CE标识。
■中度风险性医疗器械属于IIa类和IIb类,需要CE证书,并在产品包装上打上CE标识。
■高度风险性医疗器械属于III类,需要CE证书,并在产品包装上打上CE标识。
CE认证流程如下:
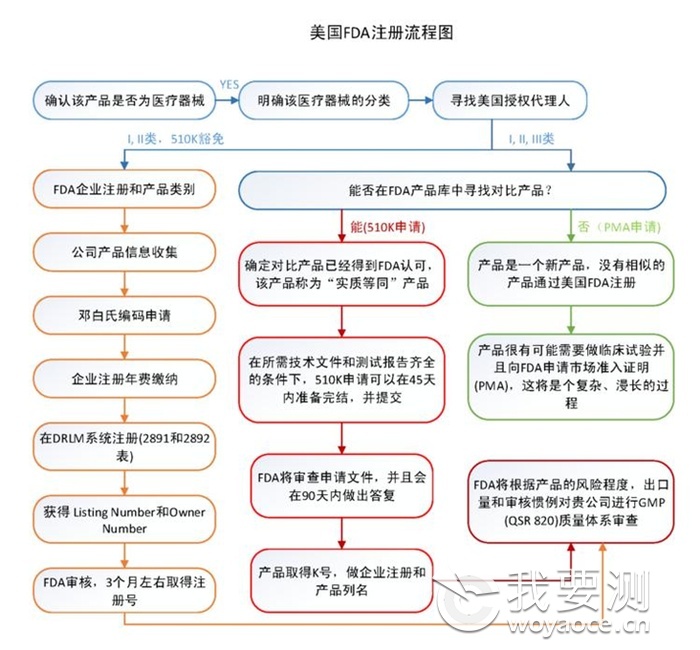
3、 美国FDA认证
FDA认证即美国食品药品监督管理局(Food and Drug Administration,简称FDA)为确保美国本国生产或进口的食品、化妆品、药物、生物制剂、设备和放射产品的安全而设立的审查机制,在美国等近百个国家,只有通过了FDA认可的材料、器械和技术才能进行商业化临床应用。根据风险等级的不同,FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ),其中Ⅲ类风险等级最高,风险等级越高则监督越多。FDA明确规定了每一种医疗器械的产品分类和管理要求,FDA医疗器械产品目录已收录超过1700多种产品。医疗器械FDA注册类型包括:
■厂家在FDA注册;
■产品的FDA登记;
■产品上市登记(510表登记);
■产品上市审核批准(PMA审核);
■医疗保健器械的标签与技术改造、通关、登记、上市前报告。
FDA认证流程如下:
四、医疗器械注册/认证需提交的申请材料有哪些?
1、中国NMPA医疗器械产品注册,需提交下列材料:
(1) 产品风险分析资料;
(2) 产品技术要求;
(3) 产品检验报告;
(4) 临床评价资料;
(5) 产品说明书以及标签样稿;
(6) 与产品研制、生产有关的质量管理体系文件;
(7) 证明产品安全、有效所需的其他资料。
2、欧盟CE医疗器械产品认证,需提交下列材料:
(1) 分析该器械的特点,确定它所属的指令范围
(2) 确定该器械的分类(风险分级)
(3) 选择相应的符合性评价程序
(4) 选择公告机构
(5) 确认适用的基本要求/有关的协调标准
(6) 确认该器械满足基本要求/协调标准, 并使证据文件化
(7) 欧盟授权代表。
(8) 欧洲注册。
(9) 对于需要公告机构评审的器械,通过公告机构的符合性程序
(10) 起草符合性声明并加贴CE标志
3、美国FDA医疗器械认证,需提交下列材料:
(1) 确定产品的分类。按照CFR TITLE 21第862-892部分,大多数的医疗器械可以按照此分类编码进行产品分类;
(2) 选择一个美国代理人(US AGENT);
(3) 注册准备1类产品直接进行工厂注册和产品列名;2类产品需要准备510(k)文件;
(4) 向FDA提交510(k)文件进行文件评审;
(5) 进行工厂注册和产品列名。
五、医疗器械注册/认证过程中有什么难点和注意事项?
一般来说,医疗器械注册认证过程中有以下几点需要注意:
一是分析医疗器械特点,根据医疗器械的定义及风险等级,结合产品的预期用途、结构组成及产品描述,来综合判定产品的类别;
二是根据设计开发的输入阶段产品法规、标准的收集,确定产品技术要求中的性能指标的检测依据;
三是根据产品的分类来选择医疗器械认证过程中符合性评价程序和注册流程;
四是根据产品的预期用途及预期使用用途、适用人群及产品禁忌症和不良反应等信息,来决策是否需要进行临床评价,选择合适的临床评价路径;
最后,产品上市后续监管,例如开展不良事件监测及再评价工作也是医疗产品上市后需注意的难点。
六、广电计量服务方案
随着医疗器械领域的监管日渐严格,作为国家级认可检验检测机构,广电计量可为医疗器械企业提供产品检测、产品认证、体系认证、企业培训等一站式服务,帮助客户解决市场准入问题,赢得行业先机。
信息来源: 医疗器械注册管理办法
GHTF/SG1/N071:2012, 5.1
部分认证流程源自业内网络资料整理
欲了解更多,点击进入 广电计量检测集团股份有限公司 >>
-
 关于召开2024’第八届材料与试验高端论坛的通知(第一轮)钢研纳克检测技术股份有限公司 2024-09-30
关于召开2024’第八届材料与试验高端论坛的通知(第一轮)钢研纳克检测技术股份有限公司 2024-09-30 -
 第五届中国新材料产业发展大会 —— CY-09 材料产业高质量发展论坛 诚邀您投稿并参会钢研纳克检测技术股份有限公司 2024-09-29
第五届中国新材料产业发展大会 —— CY-09 材料产业高质量发展论坛 诚邀您投稿并参会钢研纳克检测技术股份有限公司 2024-09-29 -
 喜讯丨中纺标携手得物App共筑品质新高度,服装鞋靴品质保障中心揭牌成立中纺标检验认证股份有限公司2024-09-27
喜讯丨中纺标携手得物App共筑品质新高度,服装鞋靴品质保障中心揭牌成立中纺标检验认证股份有限公司2024-09-27 -
 关于举办 2024 测量科学与产业计量测试技术报告会 — 新材料计量测试技术分会的通知钢研纳克检测技术股份有限公司 2024-09-27
关于举办 2024 测量科学与产业计量测试技术报告会 — 新材料计量测试技术分会的通知钢研纳克检测技术股份有限公司 2024-09-27 -
 CTI华测检测上海化妆品功效评估中心正式投入运营,聚力前行推动产业谋变破局华测检测认证集团股份有限公司2024-09-27
CTI华测检测上海化妆品功效评估中心正式投入运营,聚力前行推动产业谋变破局华测检测认证集团股份有限公司2024-09-27
药用复合膜异常毒性检测
塑性指数、耐火度检测
检测防割手套 ANSI
化验养发乳是否含有硝酸银?












评论