6家企业飞行检查通报
导读8月18日,国家药监局发布了关于永城市科技试验厂飞行检查情况的通告。
8月18日,国家药监局发布了关于永城市科技试验厂飞行检查情况的通告。根据通告内容,永城市科技试验厂质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定,国家药品监督管理局责成河南省药品监督管理局依法责令企业立即停产整改。此外,国家药监局还发布了对上海华雅化妆品有限公司等5家企业飞行检查通报。详情如下:
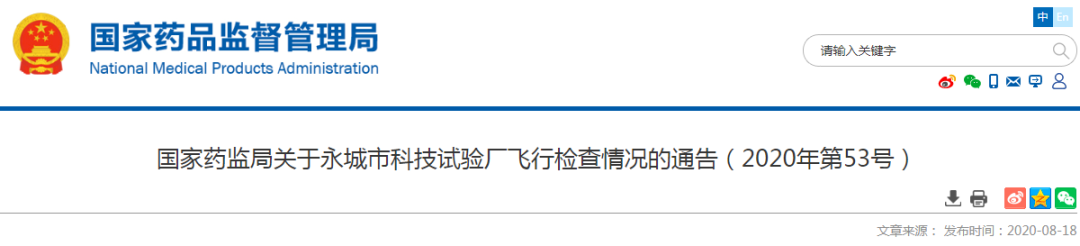
国家药监局关于永城市科技试验厂飞行检查情况的通告
(2020年第53号)
国家药品监督管理局组织对永城市科技试验厂进行了飞行检查,发现企业质量管理体系主要存在以下缺陷:
(一)机构与人员方面。企业仅有两名专职检验员,检查期间一名不在岗,另一名检验员无法完成不在岗检验员承担的含氮量检验、粘合强度等出厂检验项目。不符合《医疗器械生产质量管理规范》(以下简称《规范》)和《医疗器械生产质量管理规范附录无菌医疗器械》中企业应当配备与生产产品相适应的专业技术人员、管理人员和操作人员,具有相应的质量检验机构或者专职检验人员的要求。
(二)厂房与设施方面。企业洁净区(含万级)用风机过滤机组代替空调净化系统,仅有高效过滤单元,无初中效过滤器,且更换周期为一年,企业的生产环境监测记录仅有手写抄录的数值,没有任何原始数据佐证。不符合《规范》中厂房与设施应当根据所生产产品的特性、工艺流程及相应的洁净级别要求合理设计、布局和使用的要求。
(三)生产管理方面。企业在产品生产过程中没有检验状态标识,也没有随工单标识检验状态,成品库待检区黑塑料袋中装载产品只有普通纸条记录了生产批号和数量,没有检验状态标识,不符合《规范》中应当建立产品的可追溯性程序,规定产品追溯范围、程度、标识和必要的记录的要求。企业未按照产品技术要求规定对产品进行最终灭菌,不符合《规范》中应当按照建立的质量管理体系进行生产以保证产品符合强制性标准和注册或备案的产品技术要求的要求。永城市科技试验厂质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定。企业已对上述质量管理体系存在缺陷予以确认。国家药品监督管理局责成河南省药品监督管理局依法责令企业立即停产整改,对涉及违反《医疗器械监督管理条例》及相关法律法规的,依法严肃处理;责成河南省药品监督管理局责令企业评估产品安全风险,对有可能导致安全隐患的,按照《医疗器械召回管理办法》的规定召回相关产品。企业完成全部项目整改并经河南省药品监督管理局复查合格后方可恢复生产。河南省药品监督管理局应当将企业整改情况及时报告国家药品监督管理局。特此通告。
国家药监局
2020年8月6日
对上海华雅化妆品有限公司飞行检查通报

对上海康美国际生化有限公司飞行检查通报

对北京科学城日化有限公司飞行检查通报

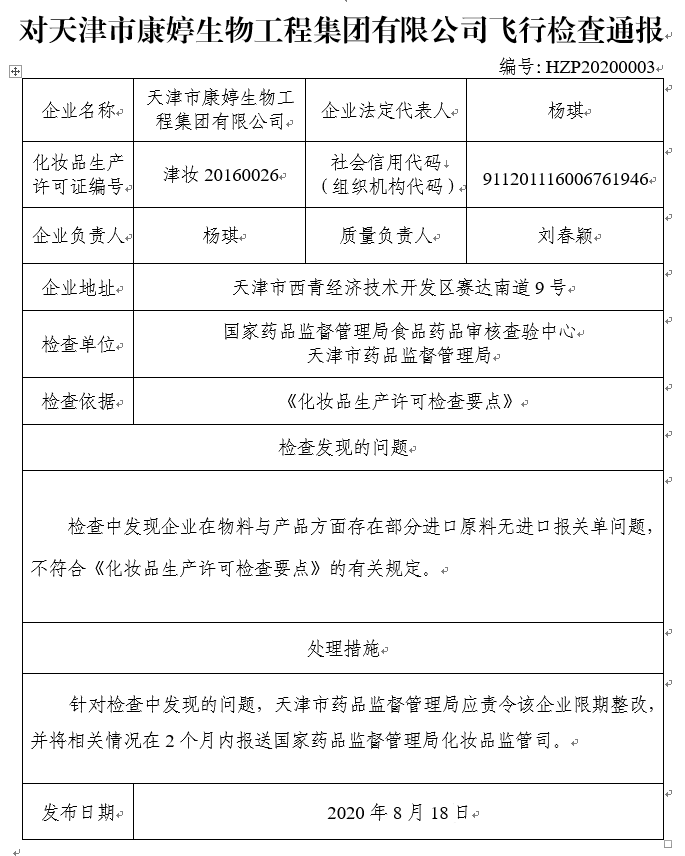
对天津市康婷生物工程集团有限公司飞行检查通报
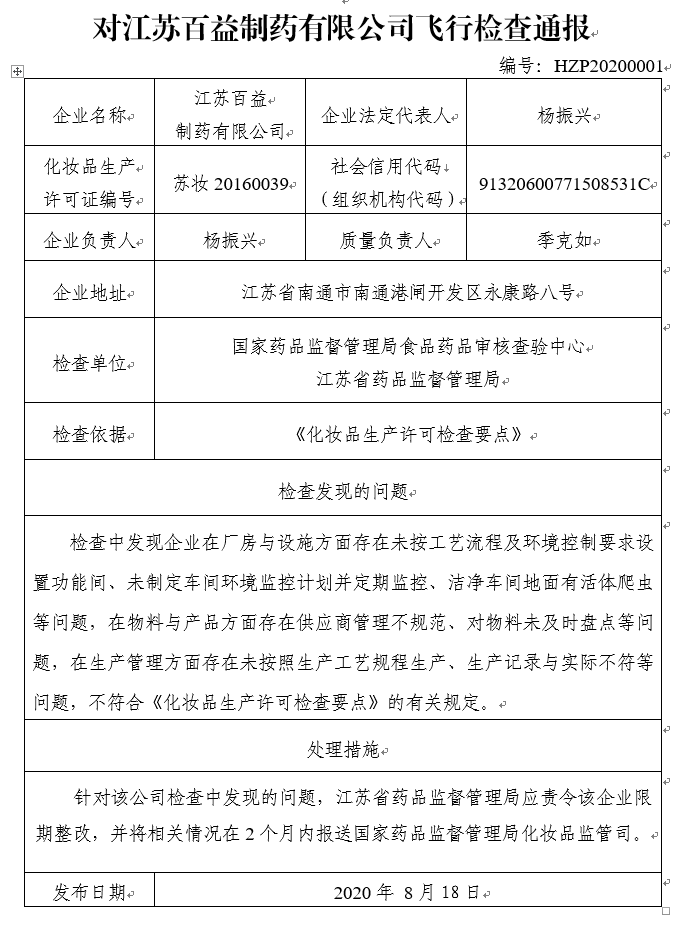
对江苏百益制药有限公司飞行检查通报
















评论