国家药监局综合司公开征求《医疗器械临床试验机构监督检查要点及判定原则(征求意见稿)》意见
国家药监局综合司 2023-04-07 点击 32 次
导读国家药监局综合司公开征求《医疗器?械临床试验机构监督检查要点及判定原则(征求意见稿)》意见。
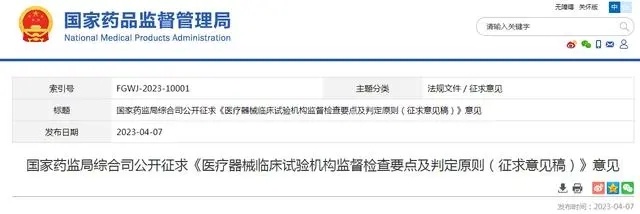
国家药监局综合司公开征求《医疗器械临床试验机构监督检查要点及判定原则(征求意见稿)》意见
为贯彻落实《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》《医疗器械临床试验机构条件和备案管理办法》《医疗器械临床试验质量管理规范》,指导药品监督管理部门规范开展医疗器械临床试验机构监督检查工作,国家药监局组织制定了《医疗器械临床试验机构监督检查要点及判定原则(征求意见稿)》(见附件1),现公开征求意见。
请填写反馈意见表(见附件2),于2023年5月5日前反馈至电子邮箱:qxzcec@nmpa.gov.cn,邮件主题请注明“机构检查反馈意见”。
附件:1.医疗器械临床试验机构监督检查要点及判定原则(征求意见稿)
2.反馈意见表
国家药监局综合司
2023年4月4日
附件1.医疗器械临床试验机构监督检查要点及判定原则(征求意见稿).doc
附件2.反馈意见表.doc
编辑:张圣斌
[来源:国家药监局综合司]













评论