巴西口罩 Anvisa & CA 认证-疫情期间
导读巴西口罩 Anvisa & CA 认证-疫情期间
情期口罩出口巴西认证方案解析
自新冠病毒疫情袭击全球之后,各国对口罩的需求量猛增,很多国内厂家咨询口罩出口巴西需要满足哪些要求和认证,现在PCN带您一探究竟。
在冠状病毒大流行(COVID-19)构成国际关注的公共卫生紧急情况(全球高风险),尤其是巴西疫情严重的当前,针对口罩出口巴西的认证要求政策有放宽松,已满足其国内需求和促进商业化。
在疫情期间,个人防护类口罩需要申请CA认证(是由巴西劳工部颁布的合格证书),依据2020年3月20日INMETRO颁发第102号法令说明暂停个人防护设备(EPI,包括口罩)认证12个月,暂停有效期至2021年3月,除非另行通知。但要求制造商保持符合标准的适当记录(例如检测报告),所以当前个人防护类口罩出口巴西可以免除INMETRO OCP的审批和审厂要求,可以直接通过有效的测试报告申请CA证书。
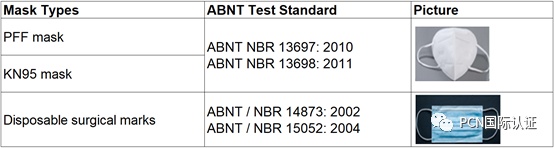
对于个人防护类口罩,如:PFF,KN95口罩(呼吸器以及微粒物过滤呼吸器),依据2014年12月23日第561号法令,测试必须在INMETRO / Cgcre或签署互认的ILAC或IAAC认可的实验室进行。
测试标准:ABNT NBR 13697: 2010
ABNT NBR 13698: 2011
在疫情期间,依据ANVISA 3月23日发布的RDC 356号决议,医用口罩等用于医疗服务的产品暂时不需要进行巴西国家卫生监督局ANVISA注册备案,不涉及审厂需求,但要求制造商保持符合标准的适当记录(例如检测报告)。虽然免于卫生注册要求但不包括以下方面:
制造商和进口商需要确保口罩符合巴西技术标准;
制造商和进口商需执行上市后负责产品质量可靠、安全和有效。
因为ANVISA的认证程序必须是由巴西进口商/当地代表执行,该代表将是产品在巴西的责任方。由于疫情,目前暂停了口罩向ANVISA注册的程序要求,所以任何的巴西公司都可以进口和销售口罩,虽然这是一个灵活期,但是该巴西公司必须满足卫生要求,因为ANVISA很可能会对其进行审查。
对于医用口罩,如:一次性医用外科口罩,不在2014年12月23日第561号法令规定范围内,这类口罩在医疗或医院使用的情况下测试必须在符合ISO 17025标准的实验室中进行。
测试标准:ABNT / NBR 14873: 2002
ABNT / NBR 15052: 2004
在测试报告中,必须呈现口罩的制造商和巴西进口商/当地代表的信息,制造商或进口商有责任根据巴西法规保证所制造产品的质量,安全性和有效性。
根据第561/2014号条例,出口巴西的口罩外包装上至少要呈现:
a)制造批次的识别;
b)生产日期;
c)口罩类别;
d)型号;
e)商标;
f)制造商和进口商的信息。
此外,为了认证和注册的目的,必须满足相关标准要求的信息。
如有疑问或者巴西认证需求,欢迎随时访问我们网站http://pcn-global.com。
PCN作为巴西ANATEL OCD和INMETRO OCP发证机构,针对巴西认证,我们有专业的团队为您提供专业、高效的认证服务,谢谢。
欲了解更多,点击进入 PCN LIMITED >>
















评论