FDA最新关于包材相容性的指导原则《医疗器械生物相容性的化学分析评价》征求意见稿和ISO 10993-182020标准都是关于医疗器械的化学表征和生物相容性评估的指导文件,但它们侧重点和目的有所不同。
1. FDA医疗器械生物相容性的化学分析评价指导原则:
- 这个文件是一份由美国食品药品监督管理局(FDA)发布的草稿指导文件,旨在为医疗器械的化学分析提供建议和方法。
- 文件提供了详细的化学分析方法,包括提取条件、提取次数、提取体积、提取温度和时间等。
n 提取条件:
- 提取条件应选择以获得最坏情况下设备中分析物的量,即模拟设备在临床使用中组织可能接触到的情况。
- 建议使用不同的溶剂(如极性、非极性、半极性)以确保广泛的化学多样性的覆盖。
n 提取次数:
- 对于每种溶剂,建议进行三次重复提取,除非有正当理由证明可以减少次数。
- 对于需要进行极限提取的情况,应进行连续的提取步骤,直到后续提取步骤中通过重量分析法或其他方法测得的提取物质的量小于首次提取测得量的10%。
n 提取体积:
- 提取体积应最小化,并根据相关出版物和/或所需的化学分析灵敏度进行论证。
- 应确保测试样品完全被溶剂覆盖。
n 提取温度:
- 提取温度应选择以模拟临床使用条件,并考虑是否需要进行夸张的提取条件(即高于临床使用的温度)。
- 例如,对于夸张的提取,建议提取温度超过临床使用温度(通常为37°C)。
n 提取时间:
- 提取时间应与设备预期的临床接触时间相匹配,并考虑是否需要进行夸张的提取条件(即超过临床接触时间)。
- 对于夸张的提取条件,建议提取时间显著长于预期的临床接触时间。
n 具体的提取条件建议(根据文件中的表格):
- 对于短期接触(<24小时):推荐夸张的提取条件或临床相关的最坏条件。
- 对于延长接触(1-30天):推荐进行彻底或夸张的提取。
- 对于长期接触(>30天):同样推荐进行彻底或夸张的提取。
这些条件旨在确保能够充分估计设备可能释放的化学物质,以便进行充分的生物相容性评估。
- 它还讨论了化学分析的适用性、参考标准、校准、灵敏度和定量化。
- 文件强调了数据报告的重要性,并提供了报告考虑的指南。
- 该文件适用于FDA监管的产品,旨在帮助制造商确保其产品的化学安全性。
2. 医疗器械生物学评价 第18部分:风险管理过程中医疗器械材料的化学表征:
- 这是中国国家标准(GB/T 16886.18)的一部分,等同采用了ISO 10993-18:2020标准。
- 它侧重于医疗器械材料的化学表征在风险管理过程中的作用。
- 文件提供了医疗器械化学表征的框架,包括确定医疗器械构造和材料组成、评估与临床已确立材料的等同性、估计化学释放等。
- 它还包括了化学表征参数和方法、化学表征数据报告的指南。
- 该标准旨在为医疗器械的生物安全性提供支持,确保材料的化学成分不会对患者造成风险。
主要差异:
- 目的和适用范围:FDA的文件更侧重于提供具体的测试和分析方法,而GB/T 16886.18则侧重于风险管理和化学表征的整体框架。
- 内容深度:FDA文件提供了更详细的操作指南和测试参数,而GB/T 16886.18则提供了一个更为概念性的框架,可能需要参考其他文件以获取具体的测试细节。
- 法规背景:FDA文件是针对美国市场的产品,而GB/T 16886.18则是中国的国家标准,两者在法律效力和适用范围上有所不同。
- 更新频率:FDA的指导文件可能会根据监管需求和科技发展进行更新,而GB/T 16886.18作为国家标准,其更新可能与国际标准ISO 10993-18的更新同步。
FDA指导原则中给出了AET计算公式

在此方程中,
A 是用于生成提取物的设备或测试物品的数量,
B 是提取物的体积(以 mL 为单位),
C 是医用设备的临床暴露量(即,在预期的临床实践下,用户在一天内将接触的设备数量),
DBT 是基于剂量的阈值(以 μg/天为单位),
UF 是一个不确定性因子,用于解释用于半量化可提取物浓度的筛选方法的分析不确定性。
参数 D 是稀释度或浓度因子(即 D = Vfinal/Vinitial)。
如果提取物被稀释,则 D > 1。如果提取物是浓缩的,则 D < 1。如果提取物未处理,则 D = 1 并包含参数D 对于 AET 计算是可选的。因此,与 未加工 (D = 1) 提取物相比,提取物的稀释导致较低的 AET 值,而提取物的浓度导致较高的 AET 值。
其中UF值的设置至关重要,计算 UF 是为了考虑在每种分析方法的 RF 中观察到的变化(例如,GC-MS 和 LC-MS的 UF 应单独确定)。我们不建议在多个检测器中测定单个 UF,也不应根据一组参考标准品的阳性检测百分比来确定 UF。GC-FID 和 GC-MS 的默认 UF 值低至 4,无需进一步说明。由于 RF变异性更大,LC-MS 分析的 UF 值可能远高于 GC-MS。与 GC-MS 分析相比,在 LC-MS 中测量的分析物的 RF 可以跨越相对较宽的范围(即,幅度大于 1000 倍)。因此,尽管有种描述如何计算 UF 值的方法,但尚未确定 LC-MS 的默认 UF 值。例如,可以使用公式UF = 1/[1-(RSD)],其中 RSD 是 RF 数据库的 1262 个 RRF 的相对标准偏差,代表广泛的化学性质。可以“收益递减点”的来建立一个适当的UF值来调整AET。
总的来说,这两个文件都是为了确保医疗器械的化学安全性,但它们在内容细节、适用范围和法规背景上存在差异。
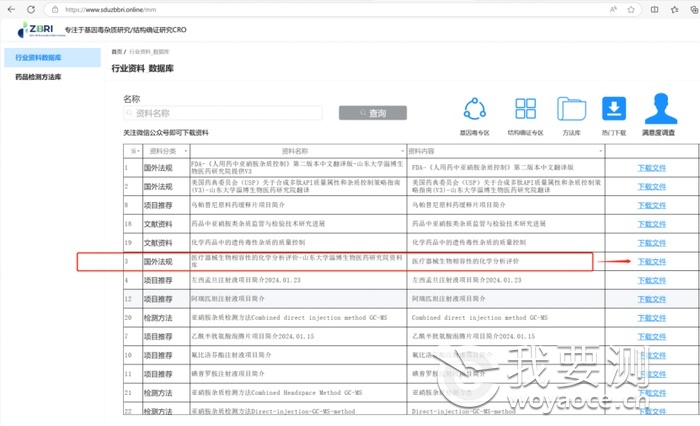
FDA最新关于包材相容性的指导原则《医疗器械生物相容性的化学分析评价》中文翻译版本下载
在研究院共享数据库,输入生物相容性,下载中文版翻译文件